
CE : EN 60601-1-2 : 2015 (V4.0) / EN60601-1 : 2006 / A1 : 2013 (V3.1)
Onyxの医療用PCは全ての製品に対して 93/42/EEC に準拠しています。
UL : ANSI / AAMI ES60601-1 : 2012 (V3.1)
Onyxの医療用PCは全ての製品に対してUL規格を取得しています。


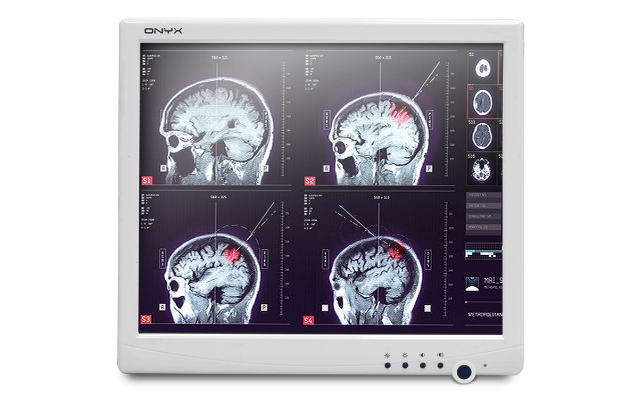
医療用AIソフトウェアをスムーズに動かしたい。
GPUやJetsonが使える医療用PCが欲しい。

普通のデスクトップPCで薬機法申請すると
巨大な変圧器をつける必要があると言われた。

ナースステーションやベッドサイドに搭載するための
タブレットやモニタが欲しい。

サンウェイテクノロジーは
Onyx Healthcare社の
正規販売代理店です
Onyx HealthcareはASUSグループ傘下の医療用PCのベンダーです。
各種医療規格の認証を取得し、Box PC 、タッチパネルPC、モバイルタブレットなどの
ヘルスケアソリューションを病院/医療IT市場に提供しています。
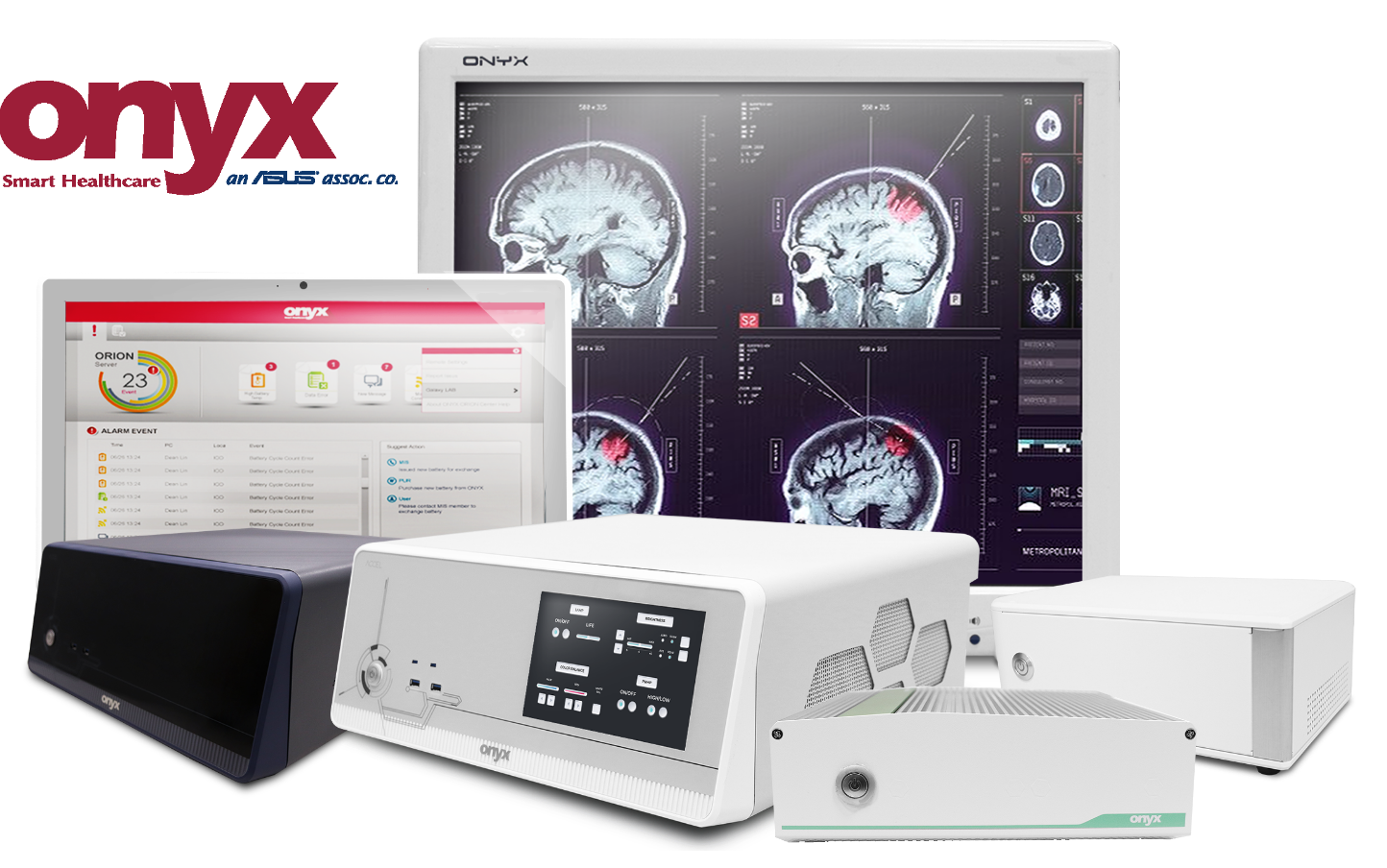
製品紹介 -AI医療コンピュータ&スマート手術室パネルPC-
Onyx Healthcareは、エッジでのAI推論に特化した新製品を開発しています。
AI対応の医療用PCには、NVIDIA GPUを搭載した、AI Box PC、推論用モバイルタブレット、医療用パネルPCなどがあります。










医療用AI ACCELシリーズ
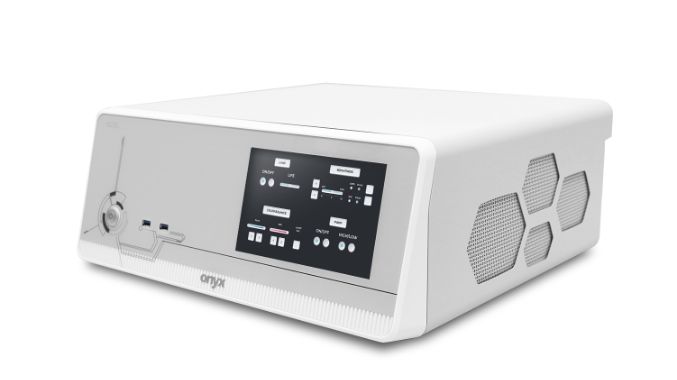
医療用Box PC
医療用パネルPC
その他
医療用Box PC

MEDPC-9210
- 第13世代Core i3,5,7搭載
- 廉価な医療用Box PC
医療用モニター
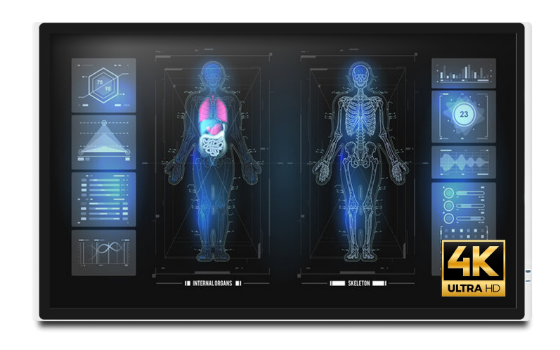
MEDDP-632
- 32inch静電容量式モニター
- 4K Ultra HD
医療用パネルPC
数々の医療認証を取得
10年以上の経験を持つ経験豊富なエンジニアが、社内外のテストラボを備え、製品が認証されており安心して導入いただけます。

品質マネジメントシステム

品質マネジメントシステム

品質マネジメントシステム

アメリカ保険業者安全試験所が策定する
製品安全規格の認証

医療施設が清掃や消毒に適した
ソリューションの提供を支援

アメリカ合衆国の通信・電波規制に準拠

中国国内の安全保護、環境保護規格

EUの基準に適合した安全規格

抗菌・防カビ・抗ウイルス加工製品に
関する品質や安全性に適合した製品
受賞歴
Onyx Healthcareは、以下の受賞以外にも全国優秀中小企業賞、National Innovation Awards で「Enterprise Innovation Award」 を受賞するなど、
毎年数々の賞を受賞しております。
2023

Computex Best Choice Award
デュアルGPUカード インテル第12世代
Core i9 CPU搭載メディカルAIエッジPC
2023

Taiwan Excellence Award 2023
医用AIコンピューティングプラットフォーム
ACCEL-JS500

品質保証 -Onyx Longevity Support -
Onyx Healthcare 製品には最低 7 年間の製品供給保証が提供されており、通常10 年間のサポート、最大15年の延長サポートも可能

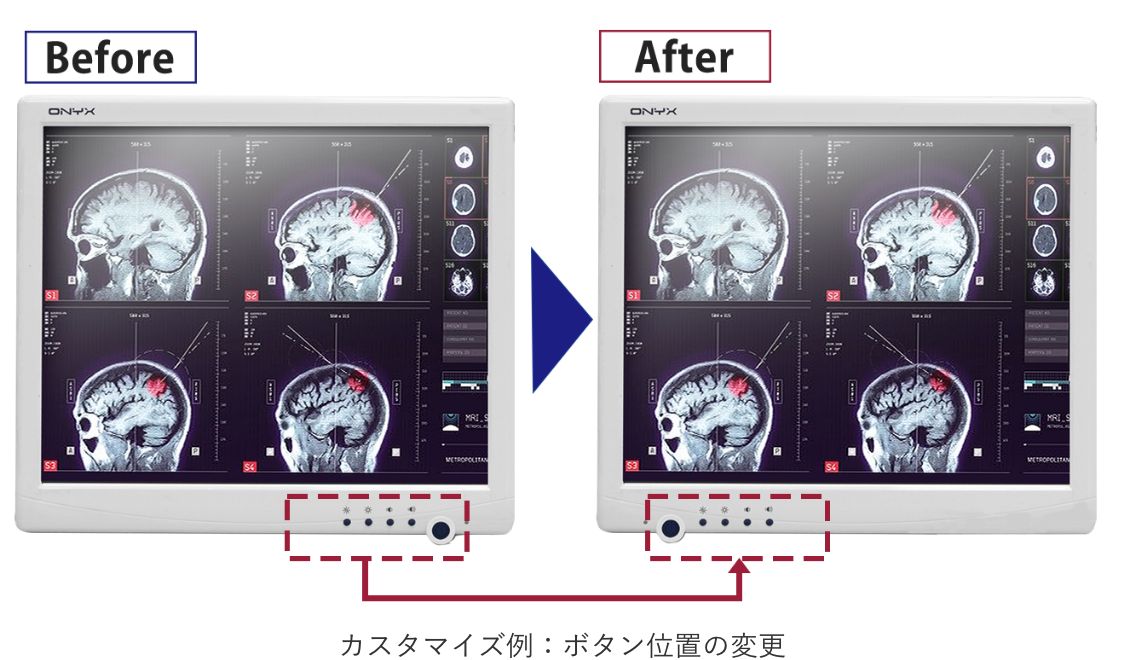
柔軟なカスタマイズ
標準製品のカスタマイズが可能
医療認証取得済の「医療AI用 メディカルPC」は、標準製品であれば対象となる
パーツはカスタマイズが可能なため、お客様の環境に最適な構成をご提案できます。
※シャーシの変更などのフルカスタマイズも条件次第で可能ですので
詳しくはお問い合わせください。
医療認証について
カスタマイズを行うことで、再認証を必要としないパーツとするパーツがあります。
組み立て・販売・サポートまで一貫サービス
オリジナルシャーシの設計・制作
マザーボード、パーツの最適な組み合わせ、シャーシの設計・製造に至るまで、オリジナル仕様の産業用PC製作を小ロットからサポートし、
お客様に最適な構成をご提案します。医療認証取得もサポートします。
FAQ
何故PCに医療規格が必要なのですか?
- 電気安全性(電気ショックや過熱・火災リスクが低い)[IEC60601-1]
- 電磁両立性(他の電子機器からの電磁干渉を受けず、また他の機器に干渉しない) [IEC60601-1-2]
PCが医用電気機器の安全性を確保するための一連の技術規格となる IEC60601-1、IEC60601-1-2に適合することで、
その電気安全性、電磁両立性が認められます。
Onyx製品が取得している医療規格は何ですか?
- FCC: Part 18
- CE : EN 60601-1-2 : 2015 (V4.0) / EN60601-1 : 2006 / A1 : 2013 (V3.1)
- UL : ANSI / AAMI ES60601-1 : 2012 (V3.1)
PCを医療現場に導入したい場合、必ず医療機器の認証が必要ですか?
政令の別表1に該当するかを確認していただく必要があります。
既存のリストに当てはまらない場合の薬事該当性についてはPMDAにご相談ください。
判定を確認/確定させたい場合は各都道府県薬務課経由(原則)で厚生労働省に該当するかをご確認ください。
医療機器に該当する場合は、薬機法の認証を取得する必要があります。
例:内視鏡やCT等の装置、手術アシストAIなど
※PCを別の機器と組み合わせる場合、最終製品が医療機器に該当するかを判断します

医療機器に該当しない場合は、そのまま導入可能です。
例:待合室の表示端末など
Onyxの医療用PCは日本でそのまま医療機器として導入可能ですか?
日本で医療機器として導入するためには薬機法の認証が必要です。
*薬機法の認証作業は、医療機器としての最終製品を販売されるお客様ご自身で行っていただくことを想定しております
それでは、日本国内では海外の認証規格を取得済であることに意味はないのですか?
薬機法で定められている医療要件基準はJIS規格を根拠としております。
実際に、薬機法認証においてハードウェア要件に「IEC60601-1相当の電気安全性、IEC60601-1-2相当の電磁両立性を持つこと」と指定される
ケースが殆どです。
基準を満たしていない汎用のPCを使った場合、
「IEC60601-1」相当にするために商用電源との絶縁分離や漏れ電流対策のために絶縁トランス等の対策が必要になる可能性があります。
「IEC60601-1-2」相当にするために電磁波を遮断する金属筐体に入れる等の対策が必要になる可能性があります。